Una de las aplicaciones más interesante de la serie de potenciales estándar es la posibilidad de predecir si una reacción redox puede ocurrir espontáneamente o no. Para ello utilizamos los potenciales de reducción independientemente de que la reacción redox dada pueda llevarse a cabo realmente en una pila voltaica.
Una reacción redox es espontánea si es positivo el valor de la fuerza electromotriz o potencial estándar de la pila que podrían formar las dos semirreacciones que constituyen la reacción redox tal como aparece en la ecuación correspondiente.
En resumen:
E0pila > 0 reacción espontánea
E0pila < 0 reacción no espontánea.
Cuando decimos que una reacción redox no es espontánea no queremos decir que sea imposible que ocurra la reacción, sino que en el equilibrio, la reacción estará muy desplazada hacia la izquierda, tal como aparece en la ecuación.
|
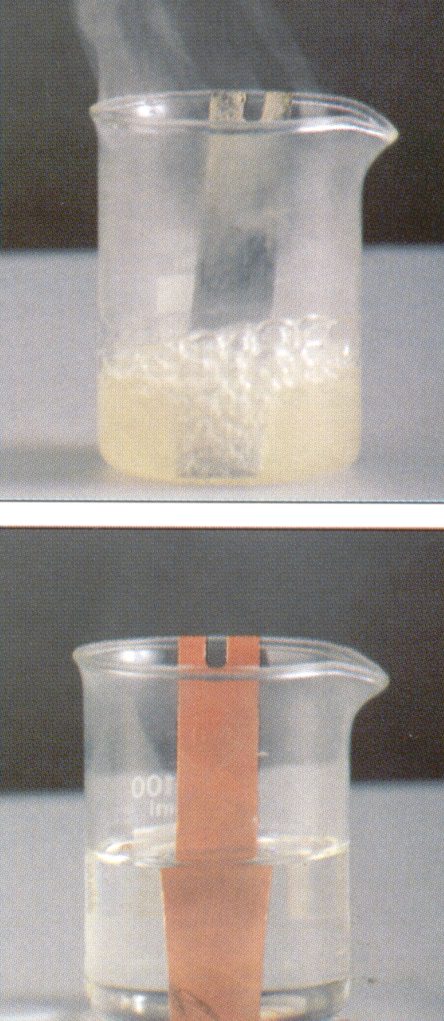
El zinc, así como otros metales activos situados por encima del hidrógeno en la serie elctroquímica,desplazan el hidrógeno de ácidos como el HCl, desprendiéndose hidrógeno gaseoso en forma de burbujas (vaso de arriba). En cambio el cobre y los metales nobles, plata, oro, platino, etc., situados por debajo del hidrógeno en dicha serie , no reaccionan con estos ácidos (vaso de abajo). |
Hemos visto que un potencial positivo de la reacción global nos indica su espontaneidad. Si se construye una pila de modo que su fem sea positiva, esto nos confirma que, en efecto, la reacción tiene una tendencia espontánea a ocurrir, impulsando a los electrones a través del circuito eléctrico. Esto nos sugiere que debe haber una relación entre la fem de una pila y la variación de energía libre, D G, de la reacción.
En las reacciones espontáneas D G < 0, y cuanto mayor sea la tendencia de la reacción a ocurrir, mayores serán el valor absoluto de D G y el valor de E. La relación entre ambas magnitudes es:
D G0 = - n F E0
en donde n es el número de electrones que figura en la ecuación redox y F es la llamada constante de Faraday, cuyo valor es 96.485 C/mol.
Inicio - Reacciones Espontáneas - Pilas Galvánicas - Potenciales Estándar de Redución - Predicción de las Reacciones Redox - Electrólisis - Leyes de Faraday - Corrosión y Prevención de la Corrosión - Problemas - Prácticas