Se estima que entre el 2 y 4% del producto bruto mundial, se debe emplear en reparar las estructuras afectadas por la corrosión. Una gran cantidad de objetos metálicos (carrocerías de automóviles, tuberías, puentes, muelles, depósitos, edificios, etc.) presentan año tras año manchas de color rojizo (el color del Fe2O3). Posteriormente, estas pequeñas manchas se convierten en pequeños y luego mayores orificios. Este fenómeno es un gran problema.
¡Tanto trabajo y dinero que ha costado obtener los metales a partir de sus minerales, y ahora resulta que de manera natural éstos vuelven a convertirse en óxidos!
Uno de los procesos de corrosión más familiares es la corrosión del hierro. Se sabe que la corrosión del hierro requiere agua y oxígeno. El hierro no sufre corrosión aunque se encuentre en contacto con agua si ésta no contiene O2. Por otra parte el hierro sumergido en aceite exento de agua tampoco se corroe aunque éste contenga O2. Otros factores, tales como el pH, la presencia de sales o el contacto con determinados metales puede alterar la corrosión del hierro.
La corrosión del hierro es de naturaleza electroquímica:
O2(g)+4 H+ + 4e- ® 2 H2O(l)
En el transcurso de la corrosión, el Fe2+ formado en el ánodo se oxida hasta Fe3+. El Fe3+ forma el óxido de hierro (III) hidratado, conocido como orín o herrumbre.
En resumen, la superficie de un trozo de hierro en proceso de corrosión se puede considerar como un conjunto de pequeñas pilas voltaicas. En el ánodo de estas pilas (polo negativo) el hierro metálico se oxida a Fe2+, y en el cátodo (polo positivo) el oxígeno se reduce formando agua al final. El hierro actúa de conductor de electrones y los iones circulan por la disolución acuosa. La corriente de corrosión se puede medir y puede llegar a ser de varios amperios.
Existen dos formas principales de prevenir la corrosión, que en el caso del hierro son: el recubrimiento con capas protectoras y la protección catódica.
El metal que se pone para que se oxide , en lugar del hierro, se denomina ánodo de sacrificio. En el hierro galvanizado, la cantidad de zinc va disminuyendo con el tiempo.
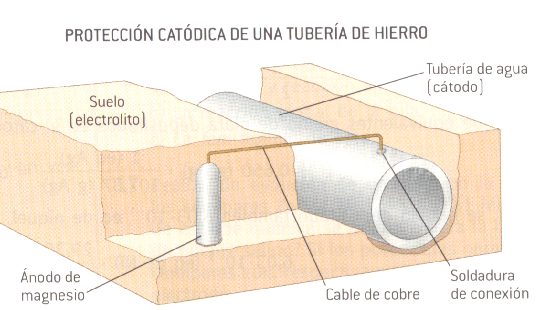
Otro ejemplo de ánodos de sacrificio se da en las tuberías subterráneas, que se protegen a menudo de la corrosión haciendo que la tubería sea el cátodo de una pila galvánica.

Junto a la tubería se entierran piezas de un metal activo (muy fácilmente oxidable), como por ejemplo el magnesio, y se conecta a ella con un cable. El metal activo hace entonces de ánodo, oxidándose, y el hierro de la tubería queda protegido catódicamente.
Inicio - Reacciones Espontáneas - Pilas Galvánicas - Potenciales Estándar de Redución - Predicción de las Reacciones Redox - Electrólisis - Leyes de Faraday - Corrosión y Prevención de la Corrosión - Problemas - Prácticas