En las pilas la energía eléctrica de una reacción redox espontanea da lugar a una corriente eléctrica. ¿Podría realizarse el proceso inverso?, es decir, ¿se podrá producir una reacción química no espontánea suministrando energía mediante una corriente eléctrica?
Sabemos que las disoluciones de los electrolitos conducen la corriente eléctrica. Pero el mecanismo de esta conducción es diferente del de la conducción de los metales, en los que la corriente eléctrica es simplemente un flujo de electrones.
En los electrolitos (disueltos o fundidos), la conducción la realizan los iones positivos (cationes) y negativos (aniones), y además siempre va unida a un cambio químico, que tiene lugar en los electrodos. El proceso recibe el nombre de electrólisis.
Así, electrólisis es el proceso por el que el paso de la corriente eléctrica por una disolución o por un electrolito fundido produce una reacción de oxidación-reducción no espontánea.
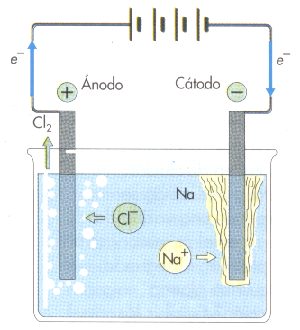
La electrólisis más sencilla de interpretar es la de una sal simple fundida. Por ejemplo, introducimos NaCl fundido en un recipiente que se llama célula o cuba electrolítica y que está provista de dos electrodos. Al hacer pasar la corriente eléctrica, se observa un desprendimiento de burbujas de cloro gaseoso en el ánodo, que es el electrodo positivo, mientras que en el cátodo, que se el electrodo negativo, se deposita sodio metálico, que flota en el fundido de NaCl.

La corriente eléctrica ha producido las siguientes reacciones redox:
(+) ánodo (oxidación): 2 Cl- } 2 e- + Cl2 E10 = -1,36 V
(-) cátodo (reducción): 2 Na+ + 2 e- } 2 Na E20 = -2,71 V
_______________________________________________
reacción global: 2 Na+ + 2 e- } 2 Na + Cl2 E0 = -4,07 V
Es decir, en el ánodo una tensión eléctrica S 1,36 V es capaz de arrancar electrones a los iones Cl-, mientras que en el cátodo, una tensión eléctrica S 2,71 V fuerza a los iones Na+ a tomar electrones.
La reacción global es que los iones del NaCl fundido se han trasformado en los elementos neutros sodio y cloro. Esta es la forma en la que se obtiene industrialmente en sodio y el cloro.
Esta reacción no es espontánea, como indica su potencial negativo. Es la reacción inversa la que es espontánea.
Para producir la electrólisis del NaCl fundido, es necesario aplicar en los electrodos una diferencia de potencial mayor que 4,07 v. Solo entonces la energía eléctrica superará a la energía química, y puede forzar a que se produzca la reacción en el sentido no espontáneo.
La electrólisis de disoluciones acuosas es algo más difícil de interpretar. Por ejemplo, si tenemos NaCl en disolución, al someterlo a electrólisis, seguiremos obteniendo Cl2 en el ánodo, pero en el cátodo se desprende H2. ¿Por qué ocurre esto?
Ahora en el cátodo pueden reducirse los iones Na+, y el agua:
Na+ + e- } Na E0 = -2,71 V
2 H2O + 2 e- } H2 + 2 OH- E0 = -0,83 V
Como puede observarse, el agua se reduce con más facilidad que el Na+, ya que tiene un potencial de reducción mayor. Por eso se obtiene H2.
Hay que tener en cuenta que los términos ánodo y cátodo no se refieren a la polaridad positiva o negativa, sino al proceso redox que tiene lugar en los electrodos:
Ánodo: oxidación
Cátodo: reducción
En la electrólisis el ánodo es el electrodo positivo y el cátodo el negativo, mientras que en la pila el ánodo es el electrodo negativo y el cátodo el positivo. Esto es lógico, ya que se trata de procesos inversos.
Inicio - Reacciones Espontáneas - Pilas Galvánicas - Potenciales Estándar de Redución - Predicción de las Reacciones Redox - Electrólisis - Leyes de Faraday - Corrosión y Prevención de la Corrosión - Problemas - Prácticas