


En una reacción redox espontánea la sustancia que se oxida, el reductor, cede los electrones a la sustancia que se reduce , el oxidante. En cuanto las moléculas del reductor entran en contacto con las del oxidante, la transferencia de electrones ocurre de forma espontánea.
Veamos dos ejemplos sencillos:
Las sales de cobre son generalmente azules. Si en una disolución acuosa de sulfato de cobre sumergimos una pieza de zinc, observamos a simple vista como la disolución va perdiendo su color azul intenso, mientras que el metal se ennegrece. Gradualmente, el zinc metálico adquiere el color del cobre. En resumen, el zinc se disuelve y el cobre se oxida. La reacción que se ha producido de forma espontánea es:
 |
 |
 |
Como es de esperar la reacción contraria no ocurre. Si introducimos una pieza de cobre en una disolución de zinc, no pasa nada.
En cambio, si ocurrirá algo si introducimos la pieza de cobre en una disolución de nitrato de plata.
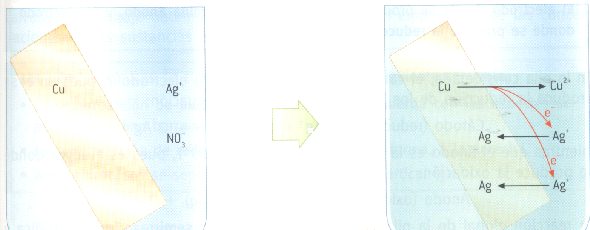
Las disoluciones de nitrato de plata son incoloras. Cuando sumergimos en una de ellas una pieza de plata y se deja transcurrir el tiempo, se observa como la barra de cobre se va plateando a la vez que la disolución va tomando el color azul característico de los iones Cu2+.
|
 |
Estos cambios se deben a que se ha producido la reacción redox espontánea:
2 Ag+(aq) + Cu(s) } 2 Ag(s) + Cu2+(aq)
Es decir, cuando dos iones de Ag+(aq) llegan a la barra de cobre metálico reciben dos electrones cedidos espontáneamente por un átomo de cobre, de modo que se reducen a plata metálica. El cobre, al ceder los dos electrones, se oxida a Cu2+ que pasa a la disolución y que al hidratarse es el responsable del color azul que ésta adquiere.
En el primer ejemplo los electrones pasan directamente del zinc al cobre sin abandonar la lámina de zinc. Del mismo modo, en el segundo ejemplo, los electrones pasan directamente del cobre a la plata cuando chocan los iones plata con la pieza de cobre.
Pero podemos proceder de forma adecuada y distinta, de modo que esa transferencia espontánea de electrones desde una especie química a otra nos resulte de gran utilidad práctica, pudiendo generar una corriente eléctrica y crear el dispositivo que conocemos como pilas.
Inicio - Reacciones Espontáneas - Pilas Galvánicas - Potenciales Estándar de Redución - Predicción de las Reacciones Redox - Electrólisis - Leyes de Faraday - Corrosión y Prevención de la Corrosión - Problemas - Prácticas