El voltaje o fuerza electromotriz (fem) de una pila, mide la diferencia de potencial entre sus dos electrodos:
Epila = Ecátodo - Eánodo
El potencial de los electrodos y por tanto la fem de la pila , depende de los materiales de los electrodos y de las concentraciones de todas las especies que intervienen en las semirreacciones de electrodo.
Se denomina fuerza electromotriz estándar o normal, y se simboliza por E0, al valor de la fuerza electromotriz de la pila cuando la concentración de todos los iones implicados en la reacción de la pila es 1M; la presión de los gases, 1 atm, y la temperatura 250C.
Si se conocieran los potenciales estándar del cátodo y del ánodo, su diferencia sería la fuerza electromotriz de la pila.
Pero no hay modo de medir el potencial absoluto de un electrodo, pues solo pueden medirse diferencias entre los potenciales de dos electrodos. Por ello, para asignar valores a los potenciales de los distintos electrodos se debe escoger uno como referencia y asignarle un valor arbitrario.
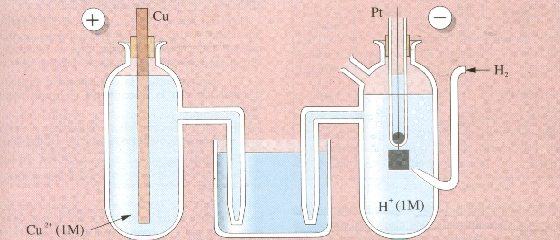
El electrodo elegido como referencia se denomina electrodo estándar o normal de hidrógeno. Consta de un electrodo de platino sobre el que se burbujea H2 gaseoso a 1 atm y que está sumergido en una disolución, a 250C, que contiene iones H+ en concentración 1 M. Por convenio, al EEH se le asigna un potencial de 0,00 voltios.
La reacción que ocurre en la superficie de platino es:
2 H+(1 M) + 2 e- H2 (1 atm ) E0H+/H2 = 0 V ( a 250C)
Si el EEH actúa como polo positivo ocurre la reacción directa, si actúa como polo negativo ocurre la inversa.
Para conocer el potencial de un electrodo, por ejemplo una barra de cobre sumergida en una disolución de iones Cu2+ 1 M a 250C, se construye una pila como la de la figura y han de recogerse dos datos:
1º La fuerza electromotriz de esta pila
2º Si el electrodo objeto de nuestra medida hace de polo positivo o de polo negativo.
Del primer dato se deduce el valor numérico y del segundo dato el signo del potencial del electrodo.

Midiendo la fem de la pila de la figura obtenemos 0,34 V. y observamos que el electrodo de cobre es el positivo, esto es:
(-) (Pt)H2(1atm)/H+(1M)//Cu2+(1M)/Cu (+) E0 = 0,34 V
Si sustituimos el electrodo de cobre por una barra de zinc sumergida en una disolución de iones Zn2+ , la fem medida es 0,76 pero en este caso el electrodo de Zn es el negativo, esto es:
(-) Zn/Zn2+(1M)//H+(1M)/H2(1atm)(Pt)(+) E0 = 0,76 V
Por tanto, los potenciales estándar de los electrodos de zinc y de cobre son:
E0Zn2+/Zn = -0,76 V E0Cu2+/Cu = + 0,34 V
Y el potencial de la pila construida con estos dos electrodos será:
E0pila = 0,34 - (-0,76) = 1,10 V
Si las concentraciones no son las estándar, es decir 1 M, se pude calcular el potencial de esa pila aplicando la ecuación de Nernst.
La serie electroquímica, proporciona una ordenación de las sustancias según sus potenciales estándar de reducción; es decir de acuerdo con su poder oxidante y reductor.

Cuanto mayor es el potencial de reducción, más acentuada será la tendencia del electrodo a reducirse, es decir, mayor será su poder oxidante.
Con los datos de la serie electromotriz o electroquímica, puede calcularse la fem de una pila formada por cualquier pareja de electrodos y predecir la polaridad de los mismos. El que tenga mayor potencial de reducción será el que se reduzca, actuando como cátodo. El de menor potencial de reducción se oxida, actuando como ánodo.
Cuanto más positivo es el potencial estándar de reducción, mayor es la fuerza oxidante de la especie oxidada que aparece en la semirreacción, es decir, mayor es la tendencia a que esta suceda en el mismo sentido en que está escrita. Como consecuencia, cada semisistema provoca la oxidación de cualquier otro situado en la tabla por encima de él. De acuerdo con esto el F2 es el agente oxidante más fuerte.
Cuanto más negativo, o menos positivo, es el potencial estándar de reducción, mayor es la fuerza reductora de la especie reducida que aparece en la semirreacción, es decir, mayor es la tendencia a que ésta tenga lugar en el sentido contrario al que está escrita. Como consecuencia, cada semisistema provoca la reducción de cualquier otro situado por debajo de él en la tabla. De acuerdo con esto, el metal litio es el agente reductor más fuerte que aparece en la tabla.
Inicio - Reacciones Espontáneas - Pilas Galvánicas - Potenciales Estándar de Redución - Predicción de las Reacciones Redox - Electrólisis - Leyes de Faraday - Corrosión y Prevención de la Corrosión - Problemas - Prácticas